藥物品質與安全
藥物品質與安全
管理方針
保瑞藥業依循國際質量標準及法規,建立完善的品管程序與系統,涵蓋藥品全生命周期的每個環節,包括研發、製造、檢驗及供應鏈管理,並制定安全管理計畫與報告,確保藥品質量安全。透過不斷提升標準作業流程及合規性,致力於守護全球患者的用藥安全,實現持續改進及卓越追求。
法規遵循與稽核
一、廠區法規依循及稽核
- 遵循法規
根據產品類型及輸出市場,保瑞各廠區遵循以下法規,並定期接受法規機關和客戶的稽核:
- PIC/S GMP
- US FDA 21CFR(美國 FDA)
- EU GMP
- Health Canada
- PMDA(日本)
- 掌握最新法規
- 公司訂閱「法規情報」,以掌握最新法規更新及FDA查廠缺失報告。
- 該資訊每月發送至各廠區,並根據需要展開相應行動。
- 每季召開分享與討論會議,促進全員了解與應對法規變化。
二、自我查核
- 查核機制
- 保瑞獨立執行自我查核,以評估品質系統的程序、規範及其他要求的適當性及遵循情況。
- 每個品質系統依據稽核計畫,至少每年進行一次稽核。
- 持續改進
- 自我查核的結果用於確保持續改進與合規,強化品質管理體系的有效性。
台灣廠區依循之標準介紹
| 廠區 |
通過查驗 年度/月份 |
依循標準 | 認證結果 |
| 竹北廠 | 2023年3月 | PIC/S GMP認證 | 通過,獲得2.4年認證 |
| 竹南廠 | 2022年12月 | PIC/S GMP認證 | 通過,獲得3.5年認證 |
| 2019年6月 | PIC/S GMP認證 | 通過,獲得3.5年認證 | |
| 2019年5月 | US FDA 21CFR查核 | 通過,0缺失 | |
| 2018年2月 | EU GMP查核 | 通過 | |
| 台南廠 | 2020年8月 | PIC/S GMP認證 | 通過 |
| 中壢廠 | 2023年11月 | TFDA PIC/S GMP認證 | 通過 |
| 2023年7月 | TFDA PIC/S GMP認證 | 通過 | |
| 2021年7月 | US FDA PAI Inspection (FDA 4003 form/Remote) 查核 | 通過 | |
| 2020年12月 | TFDA PIC/S GMP認證 | 通過 | |
| 2020年8月 | TFDA GMP/GDP認證 | 通過 | |
| 2020年2月 | US FDA GMP查核 | 通過 | |
| 2019年8月 | US FDA PAI查核 | 通過 | |
| 2018年7月 | US FDA GMP查核 | 通過 | |
| 2018年5月 | TFDA GMP/GDP認證 | 通過 | |
| 桃園廠 | 2022年12月 | US FDA PAI查核 | 通過 |
| 2021年12月 | PIC/S GMP認證 | 通過,獲得3.5年認證 |
海外廠區依循之標準介紹
| 廠區 |
通過查驗 年度/月份 |
依循標準 | 認證結果 |
| 加拿大廠 | 2024年6月 | Japanese Ordinance 2021 (PDMA)認證 | 通過 |
| 2024年2月 | Heath Canada GMP 查核 | 通過 | |
| 美國明尼蘇達及普利茅斯廠 | 2024年7月 | US FDA 21CFR (CDER PAI) 查核 | 通過 |
| 美國巴爾的摩廠 | 2024年9月 | PIC/S GMP認證 | 等待檢驗報告 |
| 2024年7月 | CBER GMP認證 | 通過 |
品質管理系統
一、產品品質管控
藥品從生產到出貨的過程中,於不同階段採取相應的管控措施,確保藥物品質:
| 步驟 | 階段 | 管控政策 |
| 1 | 原料/包材材料 |
溫度/濕度控制倉庫 供應商驗證。 統計抽樣/檢查計劃 庫存管理系統 |
| 2 | 生產 |
製程確效 線上檢查與製程中檢驗 設施/設備驗證與校正計畫 交叉污染防治計畫 環境監控 清潔確效 |
| 3 | 實驗室測試 |
分析方法開發與驗證 儀器驗證與校正計畫 標準品/試劑管理 |
| 4 | 運輸 |
運輸研究 防竄改封條 溫度監控 |
二、品質系統監控
- 品質監控機制
- 品質單位每月分析品質系統的有效性,並向高級管理階層報告。
- 高級管理階層積極推動符合規範要求的生產環境。
- 品質委員會運作
- 品質委員會由高級管理階層組織,每月召開一次會議。
- 針對各廠區出現的品質議題進行審查、解決與改善。
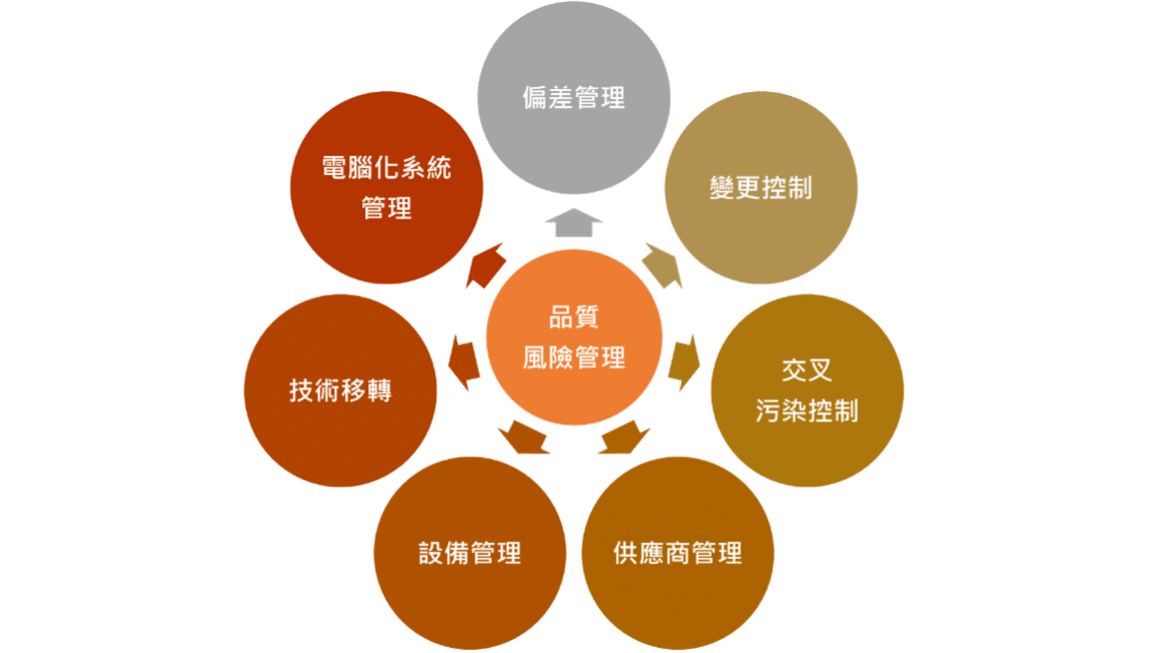
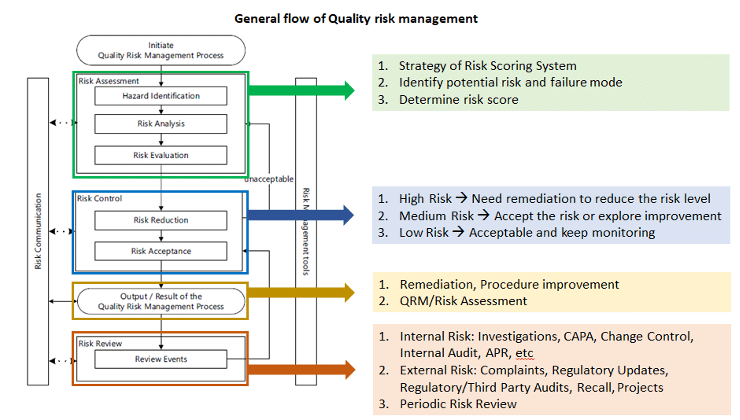
三、品質風險管理
- 風險評估與管理
- 品質風險管理依據 ICH Q9 品質風險管理規範,對產品品質進行風險評估。
- 風險管理工具應用於製程和品質系統相關潛在風險的識別、分析、評估、控制、溝通及審查。
- 即時決策與規範遵循
- 透過風險管理,保瑞得以即時做出最佳決策,積極主動地符合主管機關規範要求。
品質事件管理
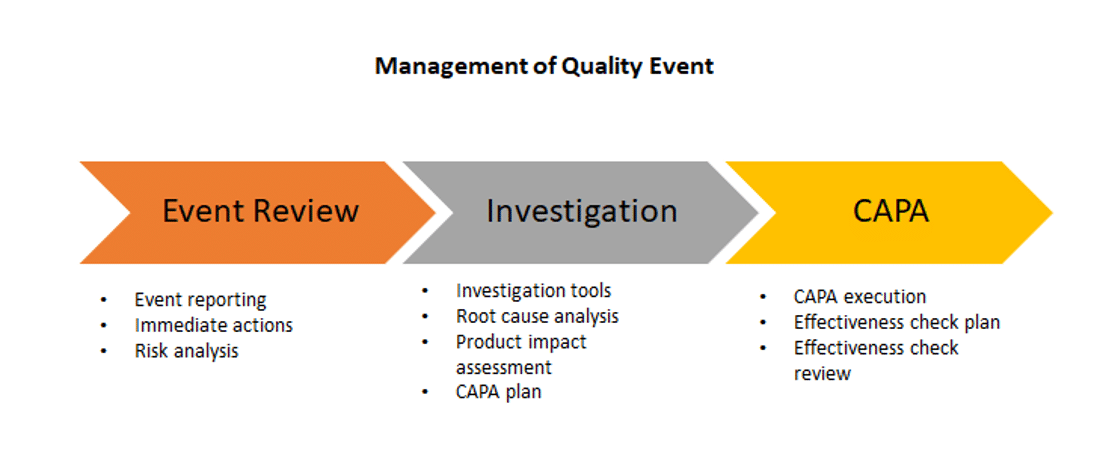
一、偏差調查與矯正預防行動
保瑞集團有完整的偏差調查管理制度並導入電子系統管理和追蹤偏差調查與矯正預防行動,流程如下:
二、重大品質事件與產品回收
- 當發現品質事件時,品質單位會評估及判定是否為重大事件並在一個工作天內通知藥證持有者。客戶會根據保瑞提供的資料來決定產品是否需要市場警示、回收、市場下架或庫存回收
- 藥證持有者負責協調產品回收、核准產品回收,並與政府主管部門/機構進行所有的溝通。需要時,保瑞會負責料品可溯性確認、相關資料收集及調查。
- 另外,保瑞每年進行至少一次的料品可溯性確認。
