管理方針
保瑞藥業依循各國主管機關要求,建立完善的品管程序與系統,涵蓋藥品全生命周期的每個環節,包括研發、製造、檢驗及供應鏈管理,並制定安全管理計畫與報告,確保藥品質量安全。透過不斷提升標準作業流程及合規性,致力於守護全球患者的用藥安全,實現持續改進及卓越追求。
法規遵循與稽核
A. 廠區法規依循及稽核
遵循法規根據產品類型及輸出市場,保瑞各廠區遵循以下法規,並定期接受法規機關和客戶的稽核:適用的法規如下:
標準:
- PIC/S GMP
- EU GMP
- 美國 FDA 21 CFR
主管機關:
- 美國食品藥品監督管理局(US FDA,美國)
- 歐洲藥品管理局(EMA,歐盟)
- 加拿大衛生部(Health Canada,加拿大)
- 日本醫藥品醫療機器綜合機構(PMDA,日本)
掌握最新法規:
- 公司訂閱「法規情報」,以掌握最新法規更新及FDA查廠缺失報告。
- 該資訊每月發送至各廠區,並根據需要展開相應行動。
- 每季召開分享與討論會議,促進全員了解與應對法規變化。
B. 自我查核
保瑞獨立執行自我查核,評估品質系統的程序、規範及其他要求的適當性與遵循情況,並依據稽核計畫每個品質系統至少每年進行一次稽核。自我查核的結果則用於確保持續改進與合規,進而強化品質管理體系的有效性。
台灣廠區依循之標準介紹
| 廠區 | 通過查驗 年度/月份 | 依循標準 | 認證結果 |
|---|---|---|---|
| 竹北廠 | 2023年3月 | PIC/S GMP認證 | 通過,獲得2.4年認證 |
| 竹南廠 | 2022年12月 | PIC/S GMP認證 | 通過,獲得3.5年認證 |
| 2019年6月 | PIC/S GMP認證 | 通過,獲得3.5年認證 | |
| 2019年5月 | US FDA 21CFR查核 | 通過,0缺失 | |
| 2018年2月 | EU GMP查核 | 通過 | |
| 台南廠 | 2020年8月 | PIC/S GMP認證 | 通過 |
| 中壢廠 | 2023年11月 | TFDA PIC/S GMP認證 | 通過 |
| 2023年7月 | TFDA PIC/S GMP認證 | 通過 | |
| 2021年7月 | US FDA PAI Inspection (FDA 4003 form/Remote) 查核 | 通過 | |
| 2020年12月 | TFDA PIC/S GMP認證 | 通過 | |
| 2020年8月 | TFDA GMP/GDP認證 | 通過 | |
| 2020年2月 | US FDA GMP查核 | 通過 | |
| 2019年8月 | US FDA PAI查核 | 通過 | |
| 2018年7月 | US FDA GMP查核 | 通過 | |
| 2018年5月 | TFDA GMP/GDP認證 | 通過 | |
| 桃園廠 | 2022年12月 | US FDA PAI查核 | 通過 |
| 2021年12月 | PIC/S GMP認證 | 通過,獲得3.5年認證 |
海外廠區依循之標準介紹
| 廠區 | 通過查驗 年度/月份 | 依循標準 | 認證結果 |
|---|---|---|---|
| 加拿大廠 | 2025 年1 月 | US FDA 21CFR | 通過 |
| 2024 年6 月 | Japanese Ordinance 2021(PDMA)認證 | 通過 | |
| 美國明尼蘇達及普利茅斯廠 | 2024年7月 | US FDA 21CFR (CDER PAI) 查核 | 通過 |
| 美國巴爾的摩廠 | 2024年9月 | PIC/S GMP認證 | 通過 |
| 2024年7月 | CBER GMP認證 | 通過 |
品質管理系統
A. 產品品質管控
- 藥品從生產到出貨的過程中,於不同階段採取相應的管控措施,確保藥物品質:
| 步驟 | 階段 | 管控政策 |
|---|---|---|
| 1 | 原料/包材材料 |
|
| 2 | 生產 |
|
| 3 | 實驗室測試 |
|
| 4 | 運輸 |
|
B. 品質系統監控
- 品質監控機制
- 品質單位每月分析品質系統的有效性,並向高級管理階層報告。
- 高級管理階層積極推動符合規範要求的生產環境。
- 品質委員會運作
- 品質委員會由高級管理階層組織,每月召開一次會議。
- 針對各廠區出現的品質議題進行審查、解決與改善。
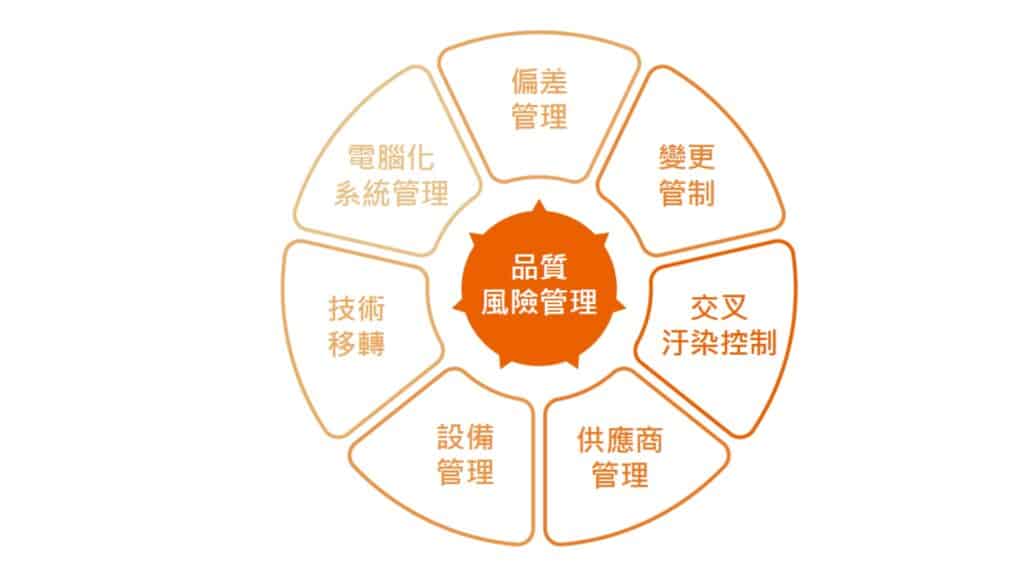
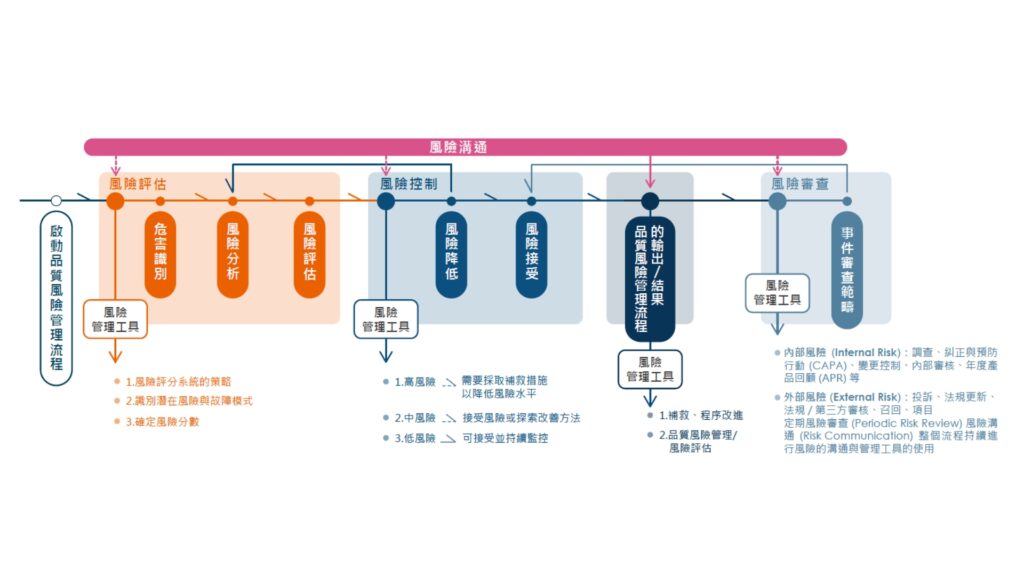
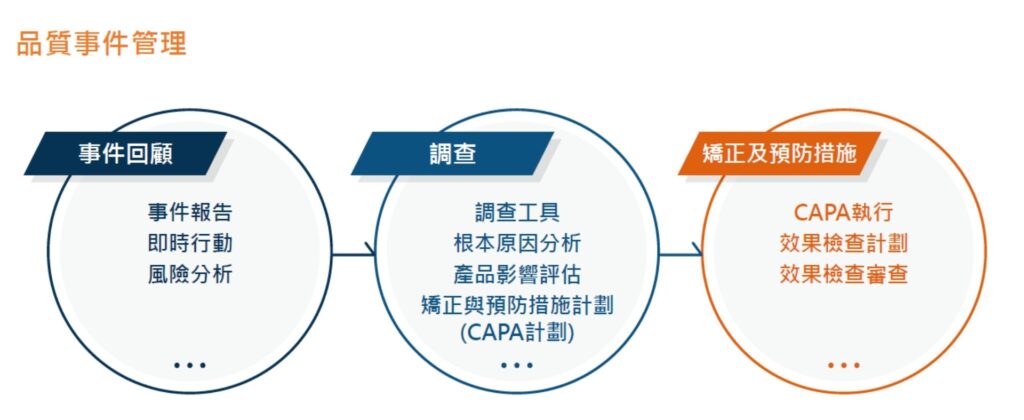
C. 品質風險管理
- 風險評估與管理
- 品質風險管理依據 ICH Q9 品質風險管理規範,對產品品質進行風險評估。
- 風險管理工具應用於製程和品質系統相關潛在風險的識別、分析、評估、控制、溝通及審查。
- 即時決策與規範遵循
- 透過風險管理,保瑞得以即時做出最佳決策,積極主動地符合主管機關規範要求。